南京大学 概览(南京大学黄硕课题组近年工作概览)
本文来自微信公众号:X-MOLNews
黄硕教授简介
黄硕,教授、博士生导师,南京大学化学化工学院、生命分析化学国家重点实验室、南京大学化学和生物医药创新研究院(ChemBIC)独立PI。2006年于南京大学物理系获得物理学学士学位;2011年于美国亚利桑那州立大学获得生物物理学博士学位;导师是Stuart Lindsay教授;2011年至2014年在英国牛津大学从事博士后研究工作,导师是Hagan Bayley教授。2015年7月至今任职南京大学化学化工学院教授。2015年入选国家海外引才计划(青年项目),2017年入选江苏省“双创人才”,2020年入选江苏省“杰出青年”,同年入选江苏省“双创团队”领军人才。现从事主要科研方向为基于单分子纳米孔生物传感器的新仪器、新技术的开发,以及基于纳米孔的单分子显微成像技术。代表性成果发表在Nature Nanotechnology, Nature Communications, Journal of the American Chemical Society, Science Advances, Angewandte Chemie International Edition, Nano Letters和Chemical Science 等国际权威期刊。

下面简要介绍课题组近年来所取得的一系列成果。
一,基于纳米孔的新型生物大分子测序技术
纳米孔技术起源于1996年,基于其极高的空间分辨率与较为直观的检测原理,纳米孔技术已经形成一个体系较为完整,功能独特的单分子分析化学手段。纳米孔测序是纳米孔技术最重要的应用场景,也是现阶段最前沿的测序手段和第三代测序技术的代表。纳米孔测序技术具备单分子分辨率、读长长、操作便携等独特优势。在宏基因组测序、病原体测序、新物种基因组测序与表观遗传学测序等多个具体的应用领域中已逐渐展示出不可替代的地位。纳米孔测序除了可以独立进行测序操作外,亦常常与其它测序方法联用。
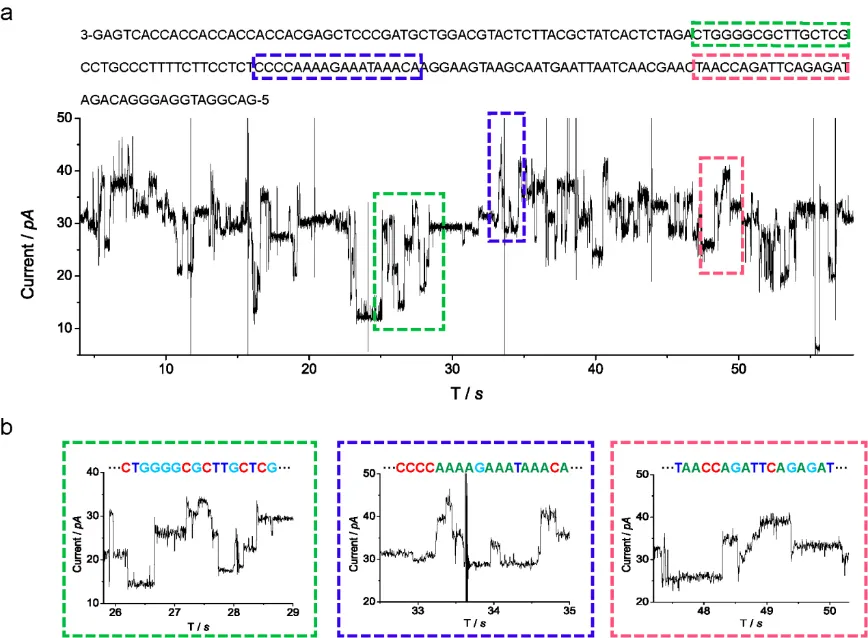
图1. 黄硕课题组近年纳米孔测序技术原创工作展示。(a) 测序数据原始数据。其中色彩框图所标注的序列和数据一一对应。(b) 上图中色彩框图数据的局部放大展示。
然而,纳米孔测序技术属于典型的“卡脖子”技术。国内在该领域起步较晚,现阶段尚缺乏国际竞争力,在相关技术产品的定价和技术共享中缺少话语权。针对紧迫的国家需求,黄硕课题组自行完成了相关孔道研制、仪器搭建、生化建库、数据分析与数据解码等多个工作环节,并在该领域以国内团队为第一通讯单位发表了多篇原创工作(图1),并且在世界范围内首次实现并报道了多肽的纳米孔测序。具体工作成果如下:
1. 核酸修饰与碱基损伤的单分子测序
核酸修饰和碱基损伤不仅对基因表达、调控有重要作用,而且在肿瘤、免疫等许多疾病的发生和防治中亦有十分重要的意义。然而核酸修饰和碱基损伤经过序列扩增之后,修饰信息也随之消失,所以它们的直接检测必须依赖于无需核酸扩增的单分子检测手段进行表征,而纳米孔测序技术就是这样一种可以直接读出碱基修饰的技术,它使得探索碱基序列深层信息成为可能。
黄硕课题组利用纳米孔测序技术在单分子水平实现了烷基化鸟嘌呤O6-CMG的直接检测。由于O6-CMG独特的负电荷特性,在纳米孔测序过程中O6-CMG可以产生独特的测序信号特征,从而实现检测区分。相较于O6-CMG的传统检测方法,纳米孔测序技术首次将O6-CMG的检测精度提高至单分子水平,且单分子测序识别准确率可高达95%以上(图2)。纳米孔测序技术不仅保留了原始碱基上的官能团修饰,还能获取O6-CMG周围的碱基序列,是目前实现O6-CMG直接精准定位的唯一方法(Angew. Chem. Int. Ed., 2019, 58, 8432-8436)。采用相似的策略,课题组亦对顺铂修饰的核酸碱基损伤首次实现了直接的单分子测序传感。其中,顺铂由于可以和孔道识别位点处的氨基酸有相互作用,在测序信号中表现为独特的高频噪音。这种高频噪音信息可以直接帮助研究者判定顺铂在核酸上的作用位点,且准确率接近100%(ACS Sens., 2021. 6, 3082-3092)。
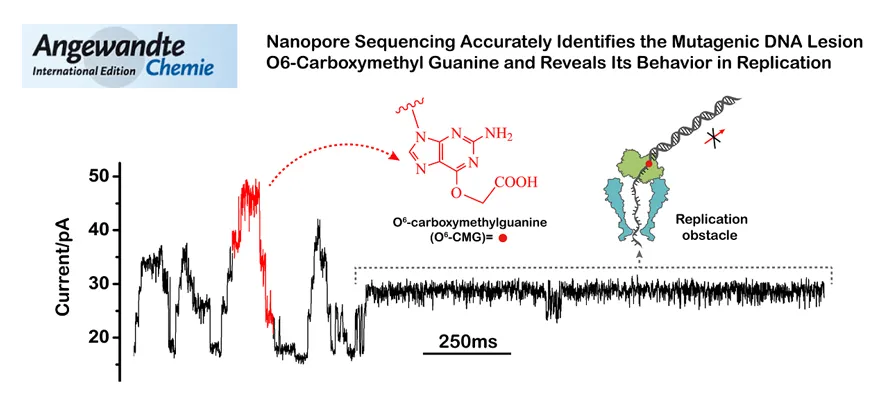
图2. 纳米孔测序技术精准识别烷基化鸟嘌呤O6-CMG并在单分子水平反映了O6-CMG是phi29 DNA聚合酶的复制阻碍。
2. 开发了纳米孔错位测序方法NIPSS
纳米孔测序技术目前主要应用在DNA和RNA上,而针对其他生物大分子如多肽、多糖、非天然核酸等的纳米孔直接测序仍然面临着巨大挑战。除了这些生物大分子自身理化性质比核酸更加复杂外,另一个挑战是缺乏与纳米孔技术兼容的马达蛋白来提供测序驱动力。为了将纳米孔测序技术推向更多生物大分子类型,课题组巧妙地避开了繁重耗时的马达蛋白筛选工作,进而提出了一种新型且通用的纳米孔测序方法即错位测序方法(Nanopore-Induced Phase-Shift Sequencing,NIPSS)。利用生物纳米孔测序体系中的错位效应,课题组和南京大学于涵洋课题组合作,首次实现了针对非天然核酸FANA的直接测序(Chem. Sci., 2019, 10, 3110)。在后续的工作中,NIPSS技术规避了繁琐的孔道和马达蛋白的探索过程,直接实现了miRNA的首次单分子测序,并可以同时获取miRNA序列中所包含的如m6A修饰碱基修饰信息(iScience, 2020, 23, 100916)。
3. 首次实现多肽纳米孔测序
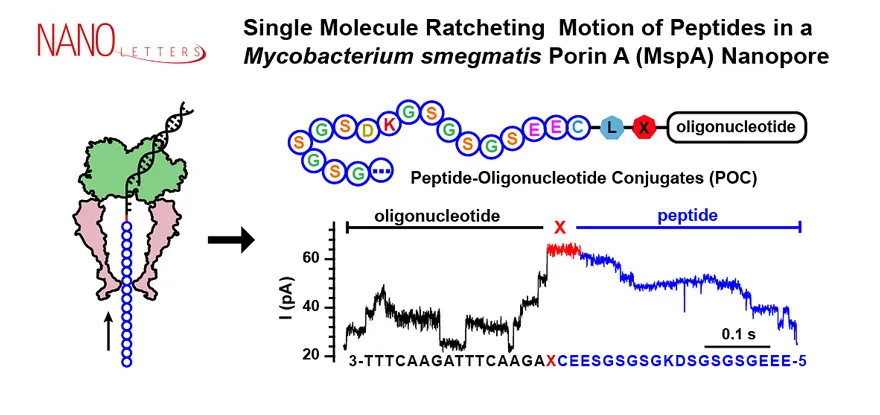
图3. 基于NIPSS技术的多肽纳米孔测序技术原型展示
课题组通过进一步开发 “纳米孔错位测序技术(Nanopore-Induced Phase-Shift Sequencing, NIPSS)”实现了多肽在纳米孔中的棘轮运动,构建了多肽的纳米孔测序技术原型(图3)。实验中,科研人员构建了多肽-DNA嵌合链实现了该测量模式。其中,嵌合链的DNA部分为“驱动链”。在NIPSS测量过程中,DNA测序酶通过拉动驱动链实现了整条嵌合链在纳米孔中的可控棘轮运动,从而实现了多肽部分的纳米孔直接读取。多肽的NIPSS信号特征具有高度一致性和序列相关性,且由单氨基酸替换引起的电流变化也可以被清楚地识别,体现了清晰的单氨基酸分辨率。通过将多肽的N端或C端与DNA驱动链进行偶联,科研人员亦成功实现了对多肽两端氨基酸序列信息的读取。该研究首次展示了多肽的纳米孔测序技术原型,为多肽测序提供了宝贵的信息和新的思路,其亦可直接应用于短肽的纳米孔直接测序或是多肽的指纹识别(Nano Lett., 2021, 21, 6703–6710)。该工作发表后在领域内引起了广泛关注,相关工作亦被《科技日报》专题报道。
二,生物大分子结构解析
针对生物大分子测序工作的常规思路是将生物大分子通过机械力线性化并顺序通过孔道。这种思路在纳米孔核酸测序和上面所介绍的多肽测序中具有很好的可行性。然而,在广泛的生物传感应用中,我们并非一定需要对所有生物分子实现测序才能实现精准识别。多数生物分子如核酸或者蛋白质表现出高度有特征的三维结构,也可以被用于提供检测信号特征。然而,主流的生物孔道往往识别位点过于狭窄,无法让具有天然结构的生物大分子通过。而开孔较大的一些生物孔道如ClyA、FraC和Phi29 promotor往往结构比较松散,在孔道组装、孔道结构稳定性和上膜嵌孔等性质上没有优势。课题组通过巧妙利用MspA纳米孔一头大一头小的结构特点,以“半阻孔”检测策略回避了改造整体结构宽大的生物纳米孔的需要。实验中,包括RNA三级结构和多种蛋白质分子均以“半阻孔”模式实现了有效的传感,即传感过程中分析物无需穿越孔道,而孔道扮演了一个纳米孔势阱的角色。由于这类“半阻孔”模式的检测信息较为动态,相应信号的信息也非常丰富,课题组于是又开发了相应的机器学习算法实现了自动化和多参数的纳米孔数据分析。具体相关工作如下:
1. 纳米孔势阱实现RNA三级结构检测
课题组报道了一种新型的纳米孔势阱检测方法,巧妙地利用MspA的宽阔前庭,将复杂结构的RNA分子捕获至其纳米空腔中,汇报其空间结构信息。同时利用孔道狭窄的识别位点汇报RNA解折叠动力学信息,以此实现miRNA, siRNA, tRNA, rRNA等低分子量RNA三级结构的高分辨检测与区分。该工作还进一步引入分子动力学模拟和人工智能算法,构建RNA的智能分检系统,并实现生物样本中RNA的直接检测(图4)。该技术打破了领域内小孔径生物纳米孔无法检测大尺寸分子的思维定式和技术瓶颈,为结构化生物大分子的直接检测提供新的思路,为研究RNA-客体分子相互作用,以及理解RNA复杂的生理功能和RNA疾病相关研究提供高分辨、免标记的单分子分析工具(Nat. Commun., 2021, 12, 3368)。
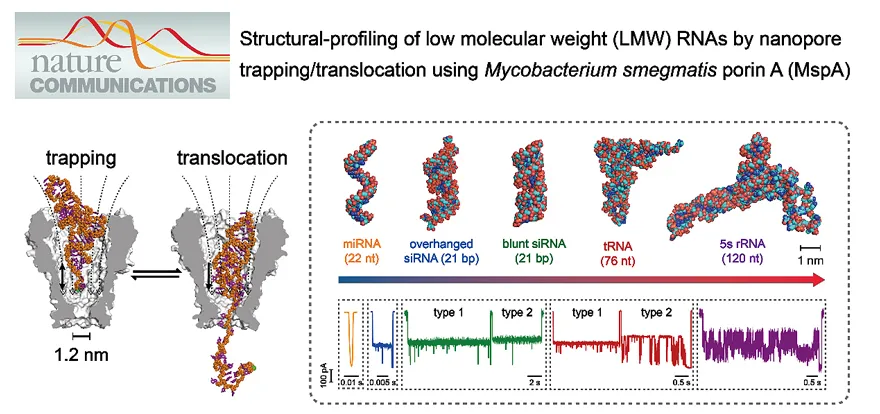
图4. 基于MspA的纳米孔捕获陷阱直接检测低分子RNA三级结构
2. MspA势阱解析蛋白结构
课题组首次将耻垢分枝杆菌膜蛋白A(MspA)系统地应用于蛋白质构象变化的无标记检测。实验中,科研人员选择钙调素(CaM)作为该策略的研究对象,对其三种常规构象异构体、病理学突变体D129G以及不同离子与其结合能力进行了全面的实验表征研究。该方案充分利用了MspA稳定性强的优点,证明MspA纳米孔不仅可以用于DNA测序、单分子化学分析和纳米孔力谱等方面,在蛋白质-配体结合以及病理学突变相关的蛋白构象变化的无标记检测方面也有巨大的应用潜力(图5)。MspA纳米孔所构建的分子势阱对蛋白质具有高灵敏度、高分辨率和低检测限,可以有效弥补溶细胞素A(ClyA),曲霉毒素C(FraC)和胸膜溶素AB(PlyAB)在表征蛋白质结构动力学方面的局限性(Angew. Chem. Int. Ed., 2021, 60, 23863–23870)。
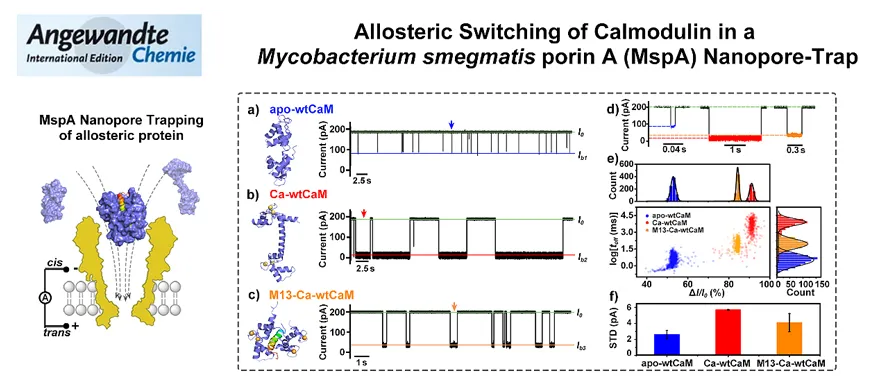
图5. 使用MspA纳米孔监测蛋白质构象转换
3. MspA电渗流纳米势阱实现蛋白质高分辨识别:
课题组开发了增强耻垢分枝杆菌孔蛋白A (MspA) 势阱对蛋白质捕获能力的新方法,将KCl/CaCl2不对称电解质缓冲液与MspA 检测系统相结合构建电渗透 (EOF) 纳米势阱(图6)。实验中,MspA纳米孔对蛋白质的捕获效率提高7~18倍,且分析时间延长达159倍,极大程度提高了纳米孔解析蛋白质的能力。使用该测试系统首次实现了不同带电性质的蛋白质的同时高分辨检测。结合机器学习算法,该系统可以应用于市售乳清蛋白中ɑ-乳白蛋白和β-乳球蛋白的快速鉴定和定量,无需对样品进行任何预纯化处理。证明了该策略在从混合物中对蛋白质的快速、高灵敏检测和实时结构分析方面的具有非常好的应用前景,为纳米孔的蛋白质无标签直接分析提供了新的思路(J. Am. Chem. Soc., 2022, DOI: 10.1021/jacs.1c09259)。
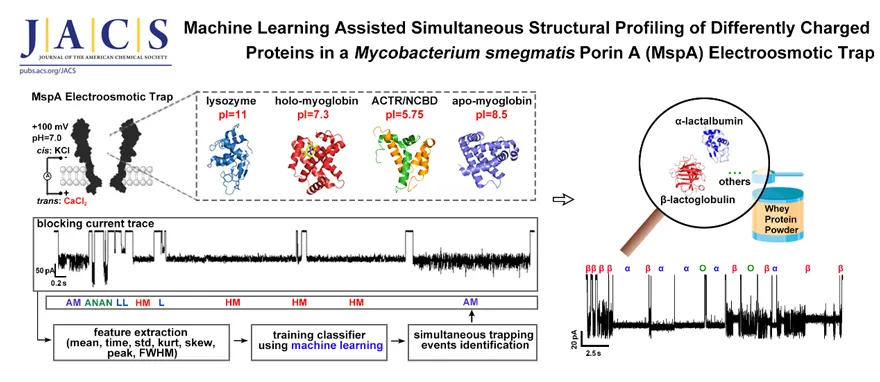
图6. MspA电渗流纳米势阱实现蛋白质高分辨识别
三,孔道单分子化学
众所周知,生物纳米孔道的检测本质是通过观测待测物分子穿过孔道产生的连续阻塞信号实现分子识别。虽然一个小分子乃至离子在阻塞孔道时也会产生阻孔信号,但是绝大部分科学家感兴趣的待测物小分子(如各种核苷酸分子、糖分子、药物分子、神经递质分子等)穿过孔道时均表现出极快的过孔信号,远远大于膜片钳体系的最大检测带宽(100 kHz)。实验中,这些过孔信号要么无法被检测到要么表现为信息高度缺失的失真信号,大大降低了检测价值。
然而,通过在孔道内引入化学特异性修饰可以延缓小分子的过孔速度至检测带宽以内。具体而言,通过构建孔道内氨基酸残基与待测分析物的动态可逆化学反应,可以有效的拉长待测物分子在孔道内的时间,并约束其过孔构型,从而实现具有高化学特异性和分辨率的单分子观测,进而清晰分辨其化学反应动力学特征,此类方法被称为孔道单分子化学。然而,早期的孔道单分子化学研究全部是通过改造结构呈桶型的α-hemolysin(α-HL)孔道来完成的,信号往往表现为幅度极小的信号抖动,缺少较好的检测分辨率,也限制了该技术的进一步发展。课题组首次报道了通过改造内腔结构更加锥形的Mycobacterium smegmatis porin A (MspA) 纳米孔实现了纳米孔单分子化学检测性质的大幅优化,提出了采用MspA纳米孔单分子反应器的新方向。具体相关工作如下:
1. 基因改造的MspA单分子化学反应器
现阶段,MspA纳米孔反应器也是性质最为优异的单分子化学反应器。通过制备一系列新型MspA纳米孔单分子反应器(图7),实现了对多种价态的金,钴,镍,锌,铅或钯等元素的直接单原子检测,所测信号均表现了10倍以上的信号放大,大幅提高了纳米孔单分子化学观测的信号分辨和区分(Nat. Commun., 2019, 10, 5668; Chem. Sci., 2020, 11, 879-887)。由于孔道传感分辨率很高,亦能对不同价态的金原子实现单分子区分(Anal. Chem., 2021, 93, 1529–1536)。以上所报道的工程化生物孔道亦展示了对铅、铬等重金属离子的直接检测能力,具有很重要的生物无机化学和环境化学意义(Chem. Sci., 2020, 11, 879-887)。
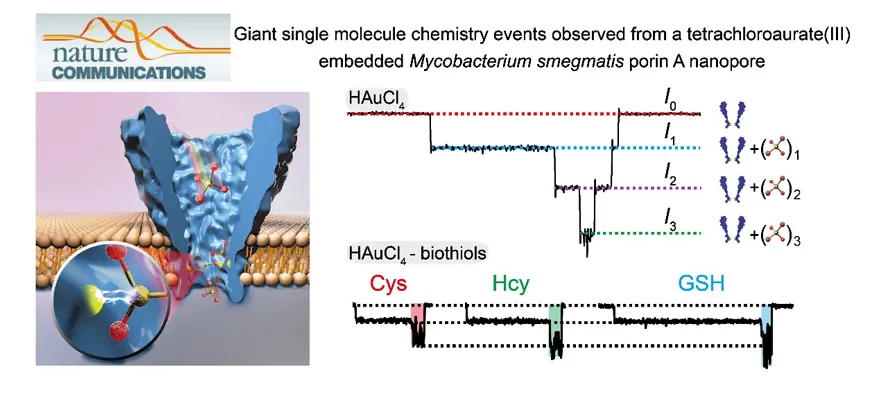
图7. MspA锥形孔道实现的金离子信号放大以及金桥联的生物硫醇传感
2. 可编程纳米孔单分子反应器
针对生物纳米孔的蛋白质和化学生物学改造具有较高的技术门槛。同时,天然MspA纳米孔往往以等价的八聚体结构呈现,因此,对其任何一个位置的改造往往都会引发等价的八个位置的相同改造,不利于构建性质可控的单分子化学反应器。为此,课题提出了一个全新的纳米孔单分子反应器构建策略,并将该技术命名为Programmable Nano Reactor for Stochastic Sensing(PNRSS)(图8)。该技术旨在打破纳米孔单分子化学研究中的技术瓶颈,可以将任何数量、组合或类型的活性基团引入纳米孔腔的任何点,以满足不同的传感分析需求。实验中,链霉亲和素拴系的聚合物链在电场力作用下充分拉伸,在聚合物链上设计的功能化反应位点可以与测量环境中自由转移的分析物结合,汇报信号。该技术具有高度可编程性,在本文研究工作中,快速构建了5种纳米孔单分子反应器,报告了20个单分子化学反应。并且该技术兼容其他生物孔道,如α-HL纳米孔等。PNRSS技术将纳米孔单分子反应器构建过程中的蛋白质工程改造,转化为合成功能性的聚合物链,这是无数生物化学实验室或公司提供的一项基础服务,大大降低了纳米孔单分子化学研究工作的门槛(Nat. Commun., 2021, 12, 5811)。
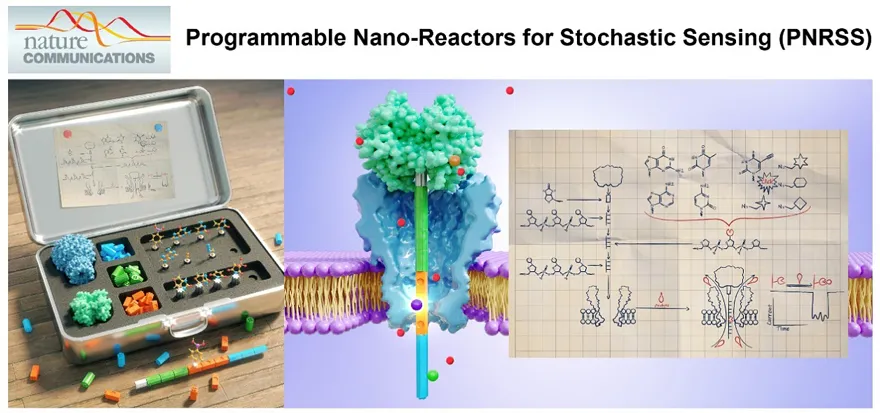
图8. 可编程纳米孔单分子反应器(PNRSS)技术概念演示
四,纳米孔成像
仿生纳米孔道家族作为一类天然膜通道蛋白,其检测机理受启发于广义的分子跨膜输运过程(PHILOS T R SOC B, 2017, 372, 20160230)。传统的纳米孔检测均使用了昂贵且难于操作的膜片钳进行信号放大与采集。该思路既不利于纳米孔检测技术的应用推广,也在检测通量上多有限制。包括纳米孔测序在内的诸多应用现阶段在仪器创制上均使用了非常昂贵的耗材和制备工艺,其根本原因在于信号读取技术上出现了瓶颈,使得纳米孔检测在通量、速度和成本之间出现了不可调和的矛盾。现阶段,纳米孔检测要么需要专业人员操作,要么成本极为高昂。具体相关工作如下:
1. 荧光纳米孔单通道测量(optical single channel recording)
纳米孔荧光成像技术使用更加简便的仪器装置,通过将钙离子流束信号转变为高度平行化的荧光成像信号,直接实现高通量、可视化与平行化的生物纳米孔检测 (Nature Nanotech., 2015, 10, 986-991; ACS Appl. Mater. Interfaces, 2018, 10, 7788-7797)。在一次检测中,上千个纳米孔道的过孔信息被转化成钙离子荧光被一并汇报出来,大大提高了系统的检测通量。然而纳米孔成像技术仍然需要专业技术人员进行操作,其检测通量受限于电化学电极的使用也仅能针对单一组分分析物的传感,难以应对多组分分析物的同时传感。
2. 无电极纳米孔检测(DiffusiOptoPhysiology)
有别于之前的研究方案,黄硕课题组受到了自然界中广泛存在的跨膜输运过程如药物或代谢物的跨膜输运、噬菌体的基因输入等现象的启发,尝试大胆简化纳米孔成像技术从而去掉电极在该体系中的必要性,并提出了首个无电极纳米孔检测技术并英文命名其为DiffusiOptoPhysiology(中文译名:光扩散泳)(Sci. Adv., 2019, 5, eaar3309)。该方法通过数学建模预测了仅使用分子扩散便可实现纳米孔发光的检测机理,并在理论模拟和实验展示中实现了从小分子、高分子至生物高分子的无电极纳米孔单分子检测,且检测芯片成本仅需1美元,具有极强的科研创新性和产业化前景(图9)。该工作发表后,获得了广泛的关注,国外媒体Physics World全文报道了本课题组的工作。同时,日本尼康公司和知名荧光试剂公司AAT Bioquest也官方推送了我们的工作,将之定位为使用荧光显微镜进行纳米孔检测的代表性工作。
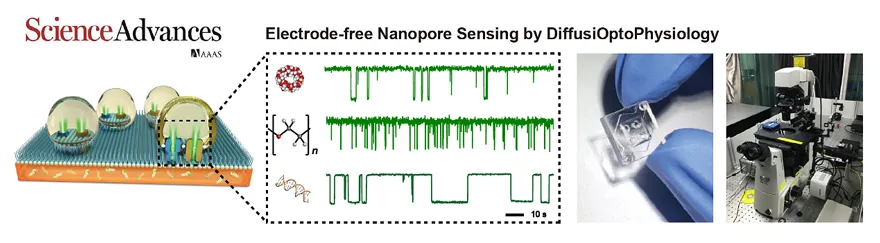
图9. 无电极纳米孔技术。该工作展示了无需电极的纳米孔单分子检测芯片概念原型。标志着纳米孔技术在去仪器化、可抛弃化的发展历史上的重大突破。其中,图片所示数据分别对应于使用无电极纳米孔检测技术对3-甲基环糊精、聚乙二醇和双链DNA通过孔道过程的观测。右侧分别展示了芯片的整体尺寸,边长约1厘米。常规倒置显微镜均可匹配测量。
黄硕课题组所创立的DiffusiOptoPhysiology方法是纳米孔单分子检测领域自1996年创立以来,首次实现的完全无需电极的纳米孔单分子检测方法。该方法整体实施思路极其简单,即使是没有任何纳米孔研究基础的团队亦可以轻松依托该概念完成单分子检测操作。国外著名专家如美国东北大学的Meni Wanunu教授、英国帝国理工Josh Edel教授以及瑞典查尔姆斯理工大学Fredrich Hook教授均在相关综述论文高度评价了该工作,认可该工作是世界上首次实现无需电极检测的纳米孔技术,并高度评价了该思路在低成本与便携性上的突出意义(Biosens. Bioelectron., 2020, 151, 111944.; Nat. Rev. Mater., 2020, 5, 931–951)。黄硕课题组对该技术的英文命名DiffusiOptoPhysiology也同样获得了同行的普遍认可(J. Am. Chem. Soc., 2020, 142,: 4481-4492.; Anal. Chem., 2020, 92, 5621-5644.; Trends Anal. Chem., 2020, 113, 116091.)。
以上为黄硕课题组近年来具有代表性的工作成果,其它更多具体详细的信息请参考该课题组网站或发送邮件至shuo.huang@nju.edu.cn进一步讨论。此外,该课题组欢迎有志于科研,并对课题组研究方向感兴趣的同学联系报考硕士/博士以及博士后岗位。
课题组网站
https://hysz.nju.edu.cn/bionano/main.htm

黄硕课题组成员
导师介绍
黄硕
https://hysz.nju.edu.cn/bionano/28401/list.htm
https://www.x-mol.com/university/faculty/56491
课题组网页
https://hysz.nju.edu.cn/bionano/main.htm
下一篇:重庆985大学有哪些(西南)








